
|
|||||||||||||||
|
|
|
|
|||||||||||||
Tạp hóa - Xã hộiHóa học thường thức: Nước (bài 2) – mẹo “ăn gian” để luộc đậu mềm và luộc rau xanh 15. 08. 16 - 6:04 amHieniemic(Tiếp theo bài 1) 2. Nước là dung môi hòa tan nhiều thứ Vì là phân tử phân cực, nước cũng thích hòa tan những phân tử có một iện dương, điện âm giống nó. Hai thứ dễ gặp nhất trong nhà bếp là muối và đường đều hòa tan tốt vào nước. Muối ăn, NaCl, thực chất là một mạng lưới khổng lồ gồm rất nhiều nguyên tử natri và clo, tồn tại dưới dạng natri dương (+) và clorua âm (-). Hai thứ âm dương này nằm xen kẽ nhau, xếp thành một hình lập phương khổng lồ. Khi hòa muối vào nước, nước sẽ phá tung cấu trúc này, trộn lẫn các cục điện âm dương vào với nước, và ta thấy muối tan mất trong nước.  Tinh thể muối ăn là mạng lưới hình lập phương các ion (nguyên tử mang điện) clorua (to, xanh nhạt) và natri (nhỏ, tím). Ảnh dịch từ ảnh gốc của BruceBlaus (Public domain) Đường thì lại khác. Đường là một hợp chất hữu cơ phức tạp (cấu trúc bên dưới), cũng xếp thành tinh thể nhưng cấu trúc tinh thể không vuông vức đẹp đẽ như muối ăn. Một điểm cần đế ý là trong công thức của đường có rất nhiều nhóm OH, khá giống với công thức của nước H2O (tức H-OH). Chính tại các nhóm OH này mà nước sẽ tạo các liên kết hyđrô, vây quanh và hòa lẫn các phân tử đường, làm đường tan ra trong nước. 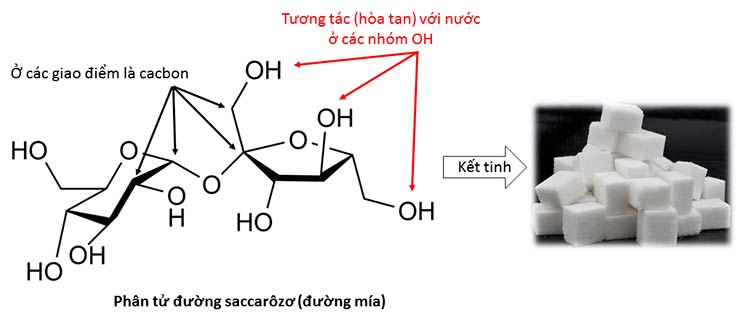 Công thức phức tạp của phân tử đường mía, khi kết tinh trong mạng tinh thể sẽ thành tinh thể đường như hình bên phải. Ảnh phải của David Pacey (public domain). Dung dịch nước muối và đường không còn sôi ở 100°C và đông đặc ở 0°C nữa. Thật ra các dung dịch này không có nhiệt độ sôi “đúng”, vì khi nước bắt đầu sôi là nước cũng bắt đầu bay hơi. Hơi nước bay ra khỏi dung dịch là hơi nước tinh khiết, đường hay muối sẽ ở lại trong dung dịch, làm cho dung dịch ngày càng đặc, và nhiệt độ cứ ngày càng tăng. Tuy thế, một dung dịch nước muối loãng hay đường loãng cũng không giúp tăng nhiệt độ sôi lên đáng kể (chỉ chừng khoảng 1°C). Muối và đường cũng làm giảm nhiệt độ đông đặc của nước xuống dưới 0°C. Pha 1% muối vào nước, ta giảm nhiệt độ đông đá được 0.6°C; pha 5%, ta giảm được 3°C. Đối với đường, khi nấu ăn, ta thường pha mạnh tay hơn: dung dịch 10% đường có nhiệt độ đông đá giảm khoảng 1°C, 40% giảm 4.5°C. Việc giảm nhiệt độ đông đặc này dễ dàng ứng dụng hơn khi chúng ta làm sorbet. Sorbet là món tráng miệng của Tây, hay được dịch là đá bào, nhưng thật ra là nước trái cây được tẩm hương gia vị, mật ong, đường, và một ít sữa (nhưng thành phần chính vẫn là nước, chứ cho nhiều sữa quá thì thành kem mất) được đông đá. Chính nhờ lượng đường lớn trong hỗn hợp này mà nhiệt độ đông đặc của nước sorbet được hạ thấp, và sorbet không bị đông cứng ngắc như nước đá. Tuy nhiên, nếu bạn làm sorbet theo công thức thì nên tuân thủ đúng lượng đường của công thức. Cho quá ít đường thì sorbet sẽ bị cứng, không múc ra được, cho quá nhiều đường thì sorbet sẽ bị chảy, không đông nổi.
 Ứng dụng tương tự là kem popsicle, tức kem nước hoa quả, không phải kem sữa. Nước đường không đông cứng như nước đá, khiến cho bạn vẫn dễ dàng cắn được cây kem. Nguồn ảnh tại đây Cuối cùng, nước cũng hòa tan cả rượu. Rượu chúng ta uống là ethanol, C2H5-OH, lại có nhóm OH giống đường ở trên giúp nước hòa tan được rượu. Nói cho chính xác thì không phải hòa tan mà là nước trộn lẫn được với rượu và tạo thành một hỗn hợp đặc biệt gọi là hỗn hợp đẳng phí, thuật ngữ tiếng Anh là azotrope. “Phí” là từ Hán-Việt, nghĩa là sôi. Chính vậy, hỗn hợp rượu nước là một hỗn hợp cùng nhau sôi, cùng nhau bốc hơi và hơi bốc lên cùng lúc có cả rượu và nước. Khi nấu ruọu, chúng ta không thể cất rượu nguyên chất từ một hỗn hợp rượu-nước, vì khi đun sôi, trong hơi rượu bay ra luôn luôn có kèm hơi nước. Tỉ lệ rượu trong hơi đun cao nhất chỉ là 95.6%, không bao giờ đạt 100%. Về rượu, xin hẹn các bạn một bài khác sẽ nói kĩ lưỡng hơn.  Khi các kỹ thuật hóa học phức tạp chưa ra đời thì dung dịch rượu ethanol đặc nhất con người tinh chế được bằng cách chưng cất là khoảng 95%. Trước đây người ta gọi hỗn hợp này là aqua vitae (nước sống, hay nước có hồn). Các nhà giả kim và hóa học thời kỳ đầu cho rằng nhờ lên men và chưng cất, họ đã thu được hồn của nước. Cách gọi rượu của nhiều ngôn ngữ phương Tây (spirits, whiskey, eau de vie,…) có nguồn gốc từ quan niệm này. Tranh vẽ hai người thợ làm cho một nhà giả kim đang chưng cất aqua vitae. Hình trích trong sách Liber de arte Distillandi (Sách về nghệ thuật Chưng cất) của Hieronymus Brunschwig, in tại Strassburg năm 1512. 3. Thang pH rực rỡ sắc màu Chúng ta biết nước là H2O, nhưng đây không phải là một điều tuyệt đối đúng. Trong nước tinh khiết luôn tồn tại một trạng thái cân bằng như thế này:
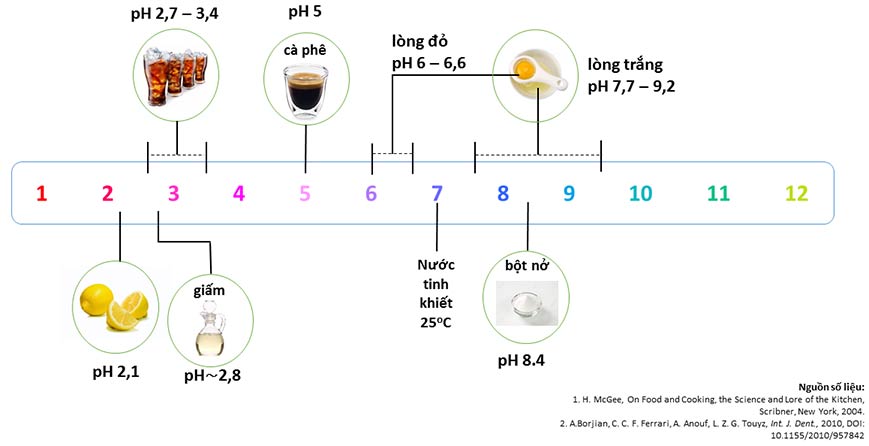
Ở đây, phân tử nước bị tách ra làm hai phần OH âm và H dương. OH âm và H dương chỉ chiếm một lượng cực nhỏ trong nước, nhưng lại cực kì quan trọng. H+ là nguyên tử hyđrô đã bị mất 1 electron duy nhất của nó nên nó chỉ còn lại 1 proton trần trụi, và người ta gọi H+ là một proton. Thang pH được đặt theo lượng proton có trong nước (pH là potentia hydrogenii, có nghĩa là hoạt độ của hyđrô). Ở nhiệt độ khoảng 25°C, nước tinh khiết có pH trung hòa là 7. Độ pH càng nhỏ thì lượng proton càng cao, độ pH càng lớn thì lượng proton càng thấp. Hàm pH là một hàm logarit 10, do đó cứ hơn 1 độ pH là hơn nhau 10 lần lượng proton. Vì nước có thể hòa tan được rất nhiều chất, các chất tan này khi vào trong nước có thể sẽ nhả thêm proton vào nước, làm giảm độ pH, ta gọi các chất đó là axit (chất toan). Các chất tan cũng có thể hút lấy proton của nước, và làm tăng độ pH, ta gọi các chất đó là ba-zơ, hoặc ba-dơ, tùy bạn thích ghi kiểu nào (chất kiềm). Các chất axit có vị chua, là do lưỡi chúng ta nhận diện proton bằng vị chua. Nhiều chất ba-zơ quen thuộc (không phải tất cả ba-zơ) có vị đắng, như xà phòng, vì chúng bám được vào các thụ thể vị giác nhận vị đắng. Ở trên là thang pH một số loại thực phẩm. Ta thấy chanh là axit nhất với pH 2,1. Giấm có pH cũng khá cao, vào khoảng 2,8. Nước ngọt có ga có tùy vào nhãn hiệu mà pH có thể từ 2,7 tới 3,4 (số liệu này trích dẫn từ một bài báo khoa học nói về tác hại của nước có ga hiệu Coca-cola và Pepsi lên men răng). Nước ngọt có độ pH cao là vì lượng CO2¬ hòa tan trong nước, cộng với axit phosphoric được cho vào thêm. Ta có thể thấy một số loại nước ngọt có độ axit ngang ngửa, thậm chí nhỉnh hơn cả giấm. Chính các axit này làm hư men răng nếu chúng ta uống nước ngọt thường xuyên và lười đánh răng. Lượng đường hoặc chất tạo ngọt cho vào trong nước ngọt gây ra vị ngọt, làm dịu đi vị chua. Cà phê cũng khá axit, vào khoảng pH 5. Lòng đỏ trứng vào khoảng 6 tới 6,6. Tuy nhiên, lòng trắng trứng lại mang tính ba-zơ, với pH từ 7,7 tới 9,2. Bột nở là muối natri bicacbonat (NaHCO3), có pH 8,4, cũng khá kiềm. Để đo độ pH trong phòng thí nghiệm, người ta dùng chất chỉ thị, dùng giấy quỳ tẩm chất chị thị, hoặc dùng máy đo pH điện hóa. Ở nhà, bạn có thể tự lấy nước bắp cải tím để biểu diễn làm chất chỉ thị pH, hoặc hướng dẫn trẻ con làm để cho vui. Bạn có thể cắt lá bắp cải ra, băm nhỏ hoặc cho vào máy xay, rồi vắt lấy nước. Phần nước bắp cải, bạn cho vào các lọ nhỏ, rồi lần lượt đổ các dung dịch có pH khác nhau như giấm, nước chanh, nước soda, nước xà phòng, thuốc sủi… Bạn sẽ thấy được một phổ màu trải từ màu đỏ sang tím tới xanh và ngả vàng về cuối như hình dưới, với điều kiện là dung dịch nước bạn cho vào không có màu quá mạnh, hoặc quá dễ phản ứng như nước tẩy (vì sẽ phá hủy hết các phân tử màu trong nước bắp cải). Các dung dịch pH thấp (axit) như nước chanh, giấm,… ngoặc việc được dùng để tạo vị chua cho thức ăn, còn dùng để vón sữa làm buttermilk chiên thịt gà như bài của Pha Lê viết. Để ứng dụng pH cao (ba-zơ) vào nấu ăn thì khó hơn. Khi luộc đậu, đặc biệt là các loại đậu cứng, bạn có thể cho vào nồi luộc một tí bột nở bicacbonate để tăng độ kiềm cho nước. Vì đậu vốn được bao bọc bởi loại polyme có tên là pectin, các sợi pectin quấn lấy nhau thành lớp vỏ bảo vệ hạt đậu; Ở môi trường axit, các sợi pectin ở trạng thái trung hòa, nhưng khi cho chất kiềm vào, các nhóm COOH của pectin bị chuyển thành COO- và lực đẩy giữa các nhóm mang điện âm này khiến các sợi pectin rời nhau ra. Ở Việt Nam (và các nước Á Đông) còn có bánh tro, hoặc bánh ú nước tro (ở miền Nam) dùng nước tro để ngâm gạo nếp cho tới khi gạo “bục”, trở nên mịn và mềm hơn, về nguyên lý hóa học cũng hệt như luộc đậu. Tro sau khi đốt cỏ cây sẽ chứa nhiều K2CO3, khi pha vào nước sẽ mang tính kiềm. Trong tiếng Anh, tro đốt cỏ được gọi là pot ash, về sau được ghi ngắn lại thành potash, và được dùng để đặt tên tiếng Anh cho nguyên tố kali (potasium). Ứng dụng tiếp theo là để luộc rau cho xanh. Khi bạn luộc rau, một trong những nguyên nhân khiến rau bị mất màu khi luộc chín quá là do ion Mg2+ của chất diệp lục bị proton (tức là H+) vào thế chỗ. Chính ion kim loại Mg trong khiến cho diệp lục có màu xanh tươi, khi proton chui vào thế chỗ trong diệp lục, nó làm cho rau chuyển sang màu xanh đen. Nếu bạn là chuyên gia luộc rau lúc nào cũng vừa chín tới xanh mươn mướt thì không nói, nhưng nếu bạn chưa phải chuyên gia thì có thể áp dụng kiến thức hóa học để chơi ăn gian trong một vài trường hợp cần kíp (ví dụ ra mắt mẹ vợ/chồng). Cho một tí bicacbonat vào nước luộc rau, nước sẽ trở nên kiềm hơn, và mang ít proton hơn, ít Mg2+ bị proton thế chỗ hơn, và bạn giữ được màu xanh của rau. Cần lưu ý một điểm ở cả hai ứng dụng trên là bạn cho ít bicacbonate thôi, nếu không đậu, gạo hay rau của bạn sẽ thoang thoảng mùi xà phòng sau khi nấu. Khi luộc rau, nếu ngại bột nở, bạn cũng có thể dùng nồi đồng hoặc nồi kẽm để luộc. Một lượng rất nhỏ đồng Cu2+ hoặc kẽm Zn2+ có thể thay thế Mg2+ bị mất trong quá trình luộc và khiến rau giữ được màu xanh.
Ý kiến - Thảo luận
7:00
Thursday,11.10.2018
Đăng bởi:
Luộc rau muống
7:00
Thursday,11.10.2018
Đăng bởi:
Luộc rau muống
Cháu ở nhà hạy bị mẹ bắt luộc rau muống và cháu nhận thấy loại rau này khi luộc chưa chín thì rau sẽ dễ bị ngả màu hơn việc luộc quá chín một chút, và điều đó chỉ được nhìn thấy sau khi đã vớt rau ra khỏi nước một lúc. Tại sao lại như vậy ạ?
14:25
Sunday,30.10.2016
Đăng bởi:
phó đức tùng
Bạn Hienemic
tại sao lại có câu "nồi đồng nấu ốc, nồi đất nấu ếch" nhỉ. Mình nghĩ đó không chỉ là câu nói vui để khó đọc nhanh, mà chắc ngày xưa các cụ nấu như vậy đó. ...xem tiếp
14:25
Sunday,30.10.2016
Đăng bởi:
phó đức tùng
Bạn Hienemic
tại sao lại có câu "nồi đồng nấu ốc, nồi đất nấu ếch" nhỉ. Mình nghĩ đó không chỉ là câu nói vui để khó đọc nhanh, mà chắc ngày xưa các cụ nấu như vậy đó. Bài đã đăng
» Xem tiếp... |
|||||||||||||||
|
|
|||||||||||||||


















...xem tiếp